Laboratórna diagnostika COVID-19
V súčasnosti sa pre diagnostiku infekcie vírusom SARS-CoV-2 v rutinnej praxi používajú dva typy laboratórnych vyšetrení – priame stanovenie nukleovej kyseliny a nepriama diagnostika založená na detekcii špecifických protilátok. Nasledujúca časť je venovaná použitiu týchto vyšetrení pre účely stanovenia diagnózy COVID-19.
Stanovenie nukleovej kyseliny RNA SARS-CoV-2
Analytická metóda
RT-PCR je polymerázová reťazová reakcia s reverznou transkripciou, pri ktorej sa RNA prepisuje do komplementárnej DNA (cDNA) prostredníctvom reverznej transkriptázy s následnou amplifikáciou cDNA. Diagnostika je zameraná na detekciu kombinácie génov v závislosti od výrobcu detekčnej súpravy. Medzi najčastejšie používané gény patria štrukturálne gény E a N, RdRp gén kódujúci RNA dependentnú RNA polymerázu a otvorené čítacie rámce ORF1a a ORF1b.
Pokyny pre odber
Pre vyšetrenie sa využíva výter z nosohltana a dutiny ústnej [1,2], spútum, prípadne materiál z bronchoalveolárnej laváže, alebo endotracheálny aspirát. Je nutné použiť špeciálne plastové výterovky s jemnou kefkou zo syntetického materiálu (dacron, nylon, polyester apod.) Výterovka NESMIE obsahovať drevo a vatu, ktoré inhibujú PCR reakciu [2]. Výterovky sa umiestňujú do tekutého transportného média pre vírusy.
New England Journal Of Medicine zverejnil skvelý inštruktážny článok o správnej metodike nazofaryngeálneho výteru aj s názornou ukážkou (článok aj video sú v angličtine): https://www.nejm.org/doi/full/10.1056/NEJMvcm2010260?query=RP
Výpovedná hodnota vyšetrenia
- RNA SARS-CoV-2 bola zistená u pacientov 1 až 3 dni pred nástupom príznakov a maximálna vírusová záťaž bola vo vzorkách z horných dýchacích ciest počas prvého týždňa infekcie, po čom nasledoval postupný pokles. V stolici a dolných dýchacích cestách je vírusová záťaž najvyššia v druhom týždni choroby. U pacientov s ťažkým priebehom je doba pozitívnej detekcie vírusu z biologického materiálu z dýchacích ciest predĺžená.
- Vyšetrenie je určené pre diagnostiku skorej fázy ochorenia- 1.-8. deň od nástupu príznakov [2-7].
- Táto diagnostika má však výraznú limitáciu vo vyšetrovanom materiáli, resp. spôsobe jeho odberu a pre odbery z horných dýchacích ciest dosahuje maximálnu senzitivitu 70-75 % (u 25-30 % pacientov s COVID-19 je vyšetrenie falošne negatívne) [2,6,7].
- Podľa štúdie [15] zameranej na sledovanie pravdepodobnosti falošne negatívneho výsledku u pacientov po expozícii, ktorí boli neskôr potvrdení ako pozitívni sa pravdepodobnosť falošne negatívneho výsledku u infikovanej osoby zníži zo 100 % v 1. deň po expozícii na 67 % v deň 4. V priemere je 5. deň považovaný za deň nástupu symptómov. V tento deň bola stredná hodnota falošne negatívnych výsledkov 38% a ďalej sa znižovala až na 20% v deň 8. (3 dni po nástupe príznakov). Následne sa začala znova zvyšovať, čo však súvisí aj s „klírens“ infekcie.
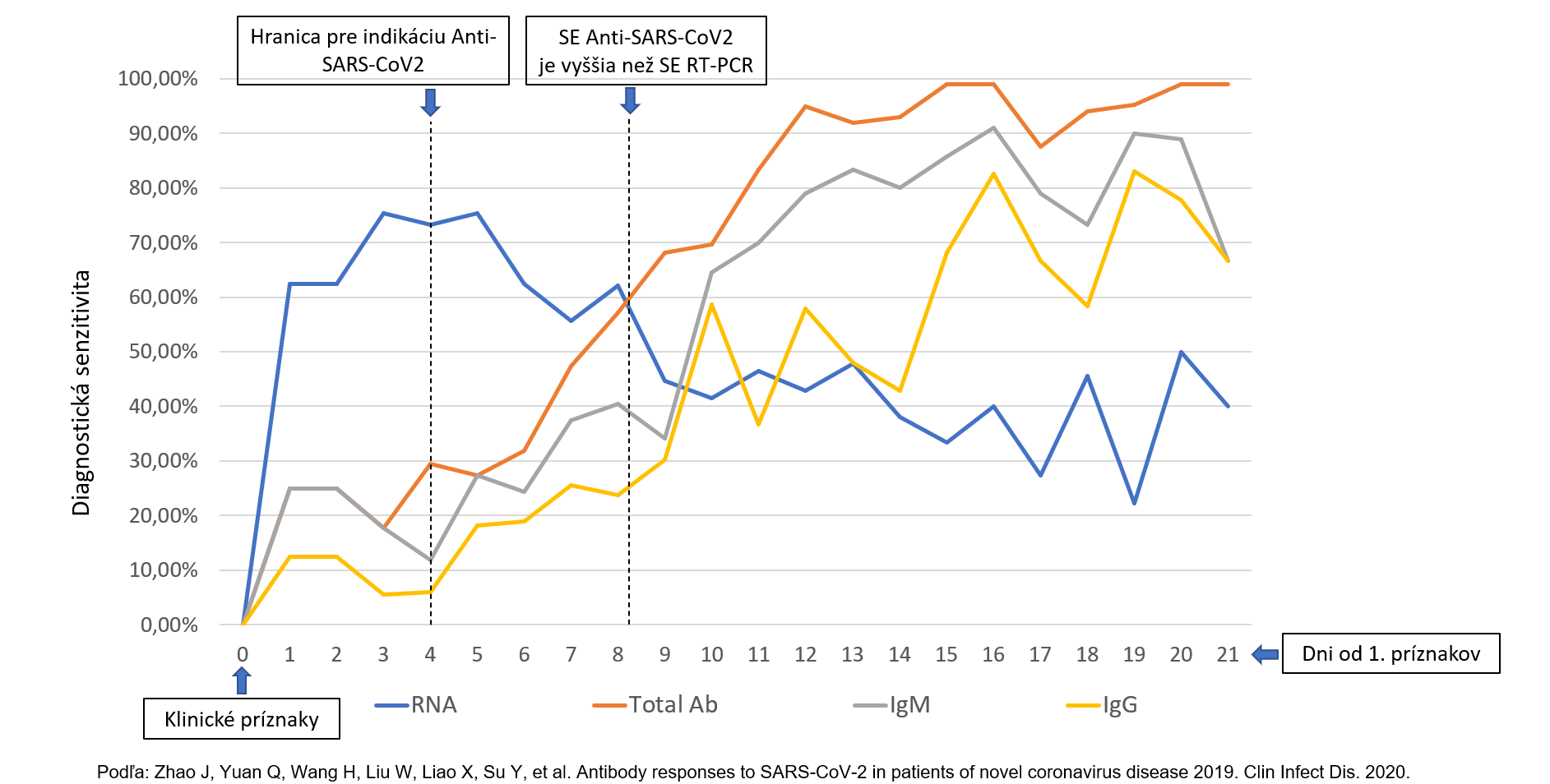
- Podľa niektorých autorov je senzitivita ešte nižšia - Wang uvádza pre orofaryngeálny výter senzitivitu pre záchyt COVID-19 len 32 %, pre nasofaryngeálny 63 % [1]. Naviac senzitivita RT-PCR prudko klesá s časom trvania infekcie (12. deň od príznakov je na úrovni 30-40 %). Naopak, diagnostická senzitivita protilátok Anti-SARS-CoV-2 v čase stúpa (Graf 1) [6,7].
- Informáciu o infekčnosti pacienta poskytuje tzv. Ct (cycle treshold) hodnota, ktorú uvádzame na výsledkovom liste. Viac o jej interpretácii uvádzame v metodickom liste.
Graf 1: Zmena diagnostickej senzitivity (SE) laboratórnych vyšetrení COVID-19 v čase
Stanovenie protilátok tried IgG a IgM proti SARS-CoV-2
Analytická metóda
Imunoanalýza, najčastejšie ELISA, alebo chemiluminiscenčná imunoanalýza. Je nutné striktne rozlišovať medzi v súčasnosti rapídne pribúdajúcimi tzv. „rýchlotestami“ a certifikovanými, validovanými (CE IVD) laboratórnymi súpravami, kde sa dá predpokladať výrazne vyššia analytická kvalita. Pre orientáciu v tejto problematike je možné použiť stránku https://www.finddx.org/covid-19/sarscov2-eval-immuno/, kde tvorcovia budú postupne pridávať výsledky nezávislého hodnotenia kvality jednotlivých testov.
Ako antigén sa v ELISA a CLIA testoch používa S proteín alebo N proteín, dokazujú sa protilátky tried IgM, IgA a IgG. Dynamika protilátkovej odpovede detekovaná rôznymi diagnostickými súpravami sa môže výrazne líšiť. Hlavným dôvodom je rozdielny cieľ diagnostických protilátok - S, alebo N proteín.
Pokyny pre odber
Štandardný odber venóznej krvi pre získanie séra - skúmavka bez aditíva (VACUETTE s červeným viečkom)
Výpovedná hodnota protilátok IgM
- Začínajú sa tvoriť 1-2 týždne od kontaktu s infekciou, pozitívne sú od 5. dňa od nástupu príznakov. Od 8. dňa je ich diagnostická senzitivita na úrovni RT-PCR a ďalej stúpa až k maximu 85-90 % (Graf 1). Pozitivita IgM protilátok výrazne klesá po 3. týždni od symptomatológie, výnimočne môže však pretrvávať 2-4 mesiace.
- Doporučené postupy zatiaľ stanovenie Anti-SARS-Cov-2 IgM uvádzajú len ako doplnkové vyšetrenie k RT-PCR pre diagnostiku COVID-19 u asymptomatických osôb a osôb s miernymi príznakmi [2,3].
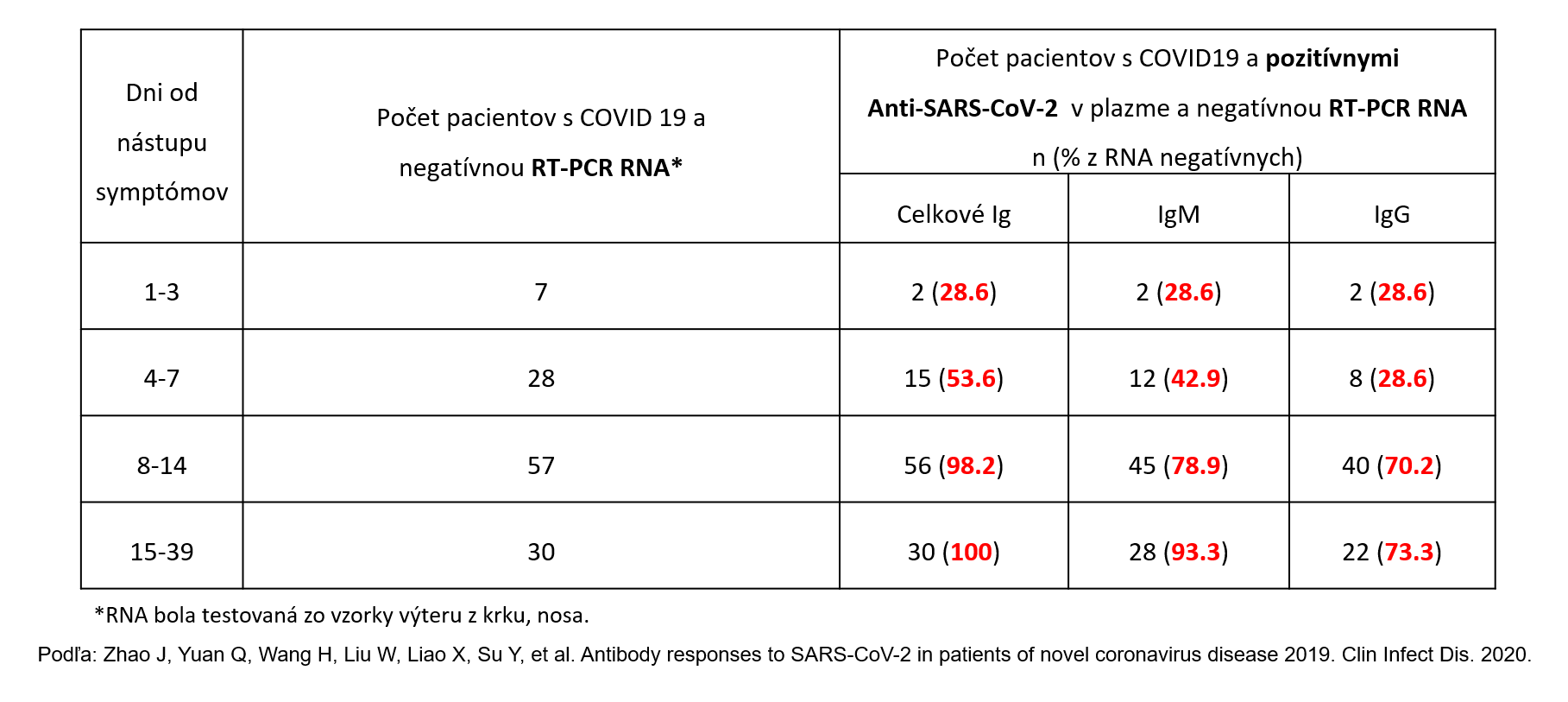
- Podľa recentných štúdií [6,7] je však možné IgM protilátky využiť aj k diagnostike, ich senzitivita je od 8. dňa od vzniku symptomatológie dokonca vyššia než senzitivita RT-PCR (Graf 1 a Tabuľka 1).
Tabuľka 1: Zmena diagnostickej senzitivity laboratórnych vyšetrení COVID-19 v čase
Výpovedná hodnota protilátok IgG
- Začínajú sa tvoriť 2.-4. týždeň od nástupu príznakov, pozitivita pretrváva niekoľko mesiacov. U imunokompetentných pacientov je nástup sérokonverzie rýchlejší ako u imunokompromitovaných.
- Ich vyšetrenie je vhodné predovšetkým k vyhľadávaniu osôb s prekonaným ochorením, alebo asymptomatickým priebehom ako súčasť epidemiologických prehľadov (napr. pre odhad šírenia pandémie, identifikáciu ohnísk nákazy, po ukončení karantény apod.).
- Koncentrácie IgG proti N antigénu boli naopak signifikantnejšie vyššie u pacientov na JIS, kontinuálny vzostup protilátok indikoval progresiu ochorenia.
- Zvýšenie IgG proti S antigénu je asociované s miernejším priebehom ochorenia (nízke CRP, bez nutnosti UPV), tento typ protilátok vykazuje signifikantne vyššie hodnoty u pacientov s miernejším priebehom ako u pacientov na JIS. Známa je tiež korelácia medzi zníženou infekčnosťou, znížením vírusovej záťaže a nárastom koncentrácie protilátok proti S-antigénu. Uvedené dáta sú v súlade s neutralizačným charakterom protilátok.
Závery pre prax
- Priamy dôkaz vírusu RT-PCR RNA je spolu s klinickými príznakmi a pozitívnou epidemiologickou anamnézou metódou voľby pre diagnostiku COVID-19 skorej fáze ochorenia (1-4 dni od začiatku symptómov) a pre posúdenie infekčnosti pacienta. Senzitivita tejto metódy veľmi závisí na mieste odberu (materiál z DDC je vhodnejší než z HDC) a kvalite odberového materiálu (drevo a vata sú známe inhibítory PCR reakcie).
- V súčasnosti je vyšetrenie Anti-SARS-CoV-2 doporučené pre epidemiologickú surveillance - identifikovanie jedincov s prekonaným ochorením, alebo miernym/asymptomatickým priebehom [2-5, 8].
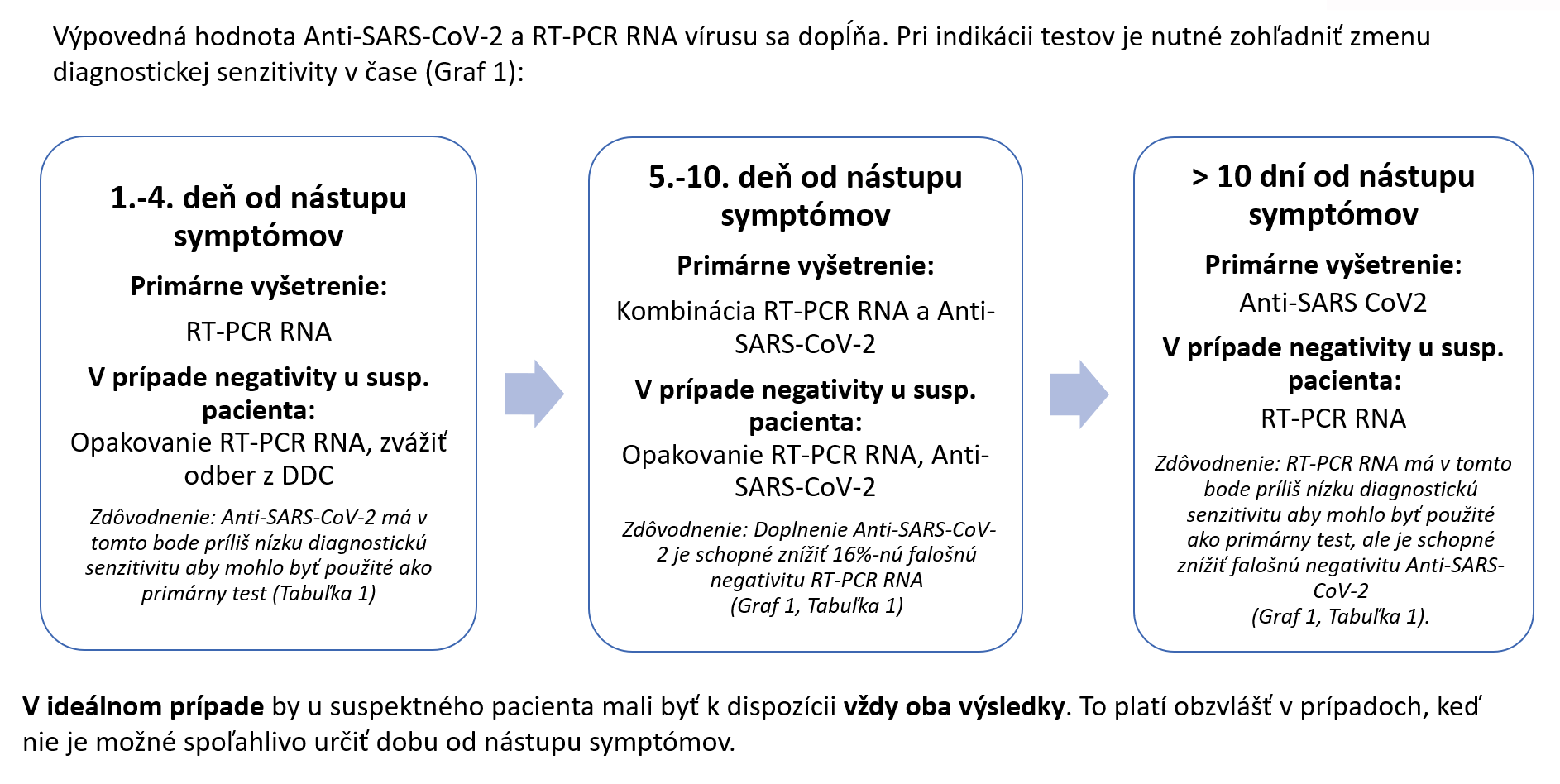
- Z výsledkov posledných štúdií je zrejmé, že každá z metód poskytuje inú, ale v prípade oboch metód diagnosticky cennú informáciu (Tabuľka 1) a vyšetrenie Anti-SARS-CoV-2 IgM má svoje miesto v diagnostike pozdejšej fázy COVID-19 (po 4. dni od začiatku symptómov). Pri voľbe metódy nutné zohľadniť zmeny jej senzitivity v priebehu trvania infekcie (Graf 1 a Schéma 1).
- Z hľadiska analytickej kvality by sa malo preferovať stanovenie protilátok CE-IVD certifikovanou a validovanou laboratórnou metódou (ak je dostupné). Pri interpretácii výsledkov je nutné brať ohľad na použitý diagnostický kit (rozdielna dynamika a prognostická hodnota Anti-S-IgG a Anti-N-IgG).
- Najvyššiu diagnostickú výťažnosť v ktoromkoľvek časovom okamihu je možné dosiahnuť pri multimarkerovej stratégii, t.j. kombináciou oboch testov, prípadne sekvenčným testovaním (Schéma 1).
- Izolované vyšetrovanie RT-PCR RNA u asymptomatických jedincov s negatívnou epidemiologickou anamnézou je veľmi sporné (výsledok odráža len situáciu v momente odberu, nie je možné zistiť fázu ochorenia - riziko vysokej falošnej negativity).
Schéma 1 : Indikácia testov pre diagnostiku COVID-19 s ohľadom na ich diagnostickú senzitivitu.
Možnosti diagnostiky COVID-19 v SK-Lab (stav k 11.12.2020)
Vyšetrenie protilátok Anti-SARS-CoV-2
- Pre stanovenie protilátok využívame CE-IVD validovanú metódu na princípe chemiluminiscenčnej imunoanalýzy. Odber indikuje a vykonáva ošetrujúci lekár, používa sa štandardná sérová skúmavka (VACUETTE, červené viečko). Vyšetrenie je hradené zdravotnými poisťovňami.
- Postup pre objedanie vyšetrenia je uvedený tu.
Vyšetrenie RT-PCR RNA vírusu SARS-CoV-2
- Od 7.5.2020 je v prevádzke odberové miesto SK-Lab pre výtery z nazofaryngu a orofaryngu. 10.8.2020 sme spustili prevádzku laboratória pre analýzu extrahumánneho genómu, kde následne prebieha izolácia a detekcia nukleovej kyseliny vírusu SARS-CoV-2 metódou RT-PCR.
- Postup pre objedanie vyšetrenia a odberu na odberovom mieste SK-Lab je uvedený tu.
Ďalšie vyšetrenia
- Laboratórny obraz pacienta s miernym/asymptomatickým priebehom COVID-19 sa v základných biochemických a hematologických parametroch podobá iným vírusovým infekciám (lymfocytóza, mierne zvýšenie CRP)
- Nepriaznivý priebeh COVID-19 je spojený s neutrofíliou, zvýšeným IL-6, PCT a CRP (signalizujú bakteriálnu superinfekciu, poškodenie pľúcneho parenchýmu), lymfopéniou (nízka reakcia imunitného sytému na vírus), zvýšením ALT, AST, bilirubínu (hepatopatia), zvýšením kreatinínu (nefropatia), trombocytopéniou, pozitívnymi D-dimérmi, predĺženým protrombínovým časom (počínajúca DIC), zvýšeným troponínom (poškodenie srdcového svalu). Tieto vyšetrenia je vhodné opakovať predovšetkým u hospitalizovaných pacientov s odstupom 2-3 dní, alebo ihneď pri zmene klinického stavu [4].
- V rámci posúdenia prognózy u pacientov s COVID-19 a monitoringu ich stavu je vhodná aj indikácia vyšetrení zameraných na bunkovú imunitu (B-Krvný obraz + dif., B-FlowCyto Panel 1, Skúmavka s EDTA – VACUETTE fialové viečko) a humorálnu imunitu (S-IgG, S-IgM, S-IgG, skúmavka pre sérum – VACUETTE červené viečko). Vyšetrenia je vhodné indikovať u suspektného pacienta spolu s RT-PCR RNA, alebo Anti-SARS-CoV-2 a v prípade potvrdenia COVID-19 následne opakovať s týždenným odstupom pre posúdenie dynamiky [9].
V prípade akýchkoľvek otázok sme k dispozícii na tel. 047/4333210, 211, a peter.secnik@sklab.sk, peter.secnikjr@sklab.sk.
Vypracovali: MUDr. Peter Sečník ml. (lekár SK-Lab), MUDr. Lenka Helmová (odborný zástupca SK-Lab pre klinickú mikrobiológiu)
Zdroje:
- Wang W, Xu Y, Gao R, Lu R, Han K, Wu G, et al. Detection of SARS-CoV-2 in Different Types of Clinical Specimens. JAMA. 2020.
- Dřevínek P., Macková B., Hubáček P.: Odborné stanovisko Společnosti pro lékařskou mikrobiologii České lékařské společnosti J.E. Purkyně k mikrobiologické diagnostice COVID-19. 25.3.2020
- Interim Guidelines for Collecting, Handling, and Testing Clinical Specimens from Persons for Coronavirus Disease 2019 - https://www.cdc.gov/coronavirus/2019-nCoV/lab/guidelines-clinical-specimens.html, date of access: 7.4.2020
- IFCC Information Guide on COVID-19 (https://www.ifcc.org/ifcc-news/2020-03-26-ifcc-information-guide-on-covid-19/), date of access: 7.4.2020
- WHO interim guidance for laboratory testing (https://www.who.int/emergencies/diseases/novel-coronavirus-2019/technical-guidance/laboratory-guidance), date of access: 7.4.2020
- Zhao J, Yuan Q, Wang H, Liu W, Liao X, Su Y, et al. Antibody responses to SARS-CoV-2 in patients of novel coronavirus disease 2019. Clin Infect Dis. 2020.
- To KK, Tsang OT, Leung WS, Tam AR, Wu TC, Lung DC, et al. Temporal profiles of viral load in posterior oropharyngeal saliva samples and serum antibody responses during infection by SARS-CoV-2: an observational cohort study. Lancet Infect Dis. 2020.
- Loeffelholz MJ, Tang YW. Laboratory diagnosis of emerging human coronavirus infections - the state of the art. Emerg Microbes Infect. 2020;9(1):747-56.
- Liu J, Li S, Liu J, Liang B, Wang X, Wang H et al. Longitudinal Characteristics of Lymphocyte Responses and Cytokine Profiles in the Peripheral Blood of SARS-CoV-2 Infected Patients (2/16/2020). Available at SSRN: https://ssrn.com/abstract=3539682 or http://dx.doi.org/10.2139/ssrn.3539682
- Neutralizing Antibodies against SARS-CoV-2 and Other Human Coronaviruses, Shibo Jiang,Christopher Hillyer,Lanying Du, dostupné na https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7098029/
- Evaluation of Nucleocapsid and Spike Protein-Based Enzyme-Linked Immunosorbent Assays for Detecting Antibodies against SARS-CoV-2, Wanbing Liu, Lei Liu, Guomei Kou, Yaqiong Zheng, Yinjuan Ding, Wenxu Ni, Qiongshu Wang, Li Tan, Wanlei Wu, Shi Tang, Zhou Xiong, Shangen Zheng, dostupné na https://jcm.asm.org/content/58/6/e00461-20
- Antibody responses to SARS-CoV-2 in patients with COVID-19, Quan-Xin Long, Bai-Zhong Liu, Ai-Long Huang, Nature Medicine volume 26, pages845–848, dostupné na https://www.nature.com/articles/s41591-020-0897-1
- Kinetics of SARS-CoV-2 specific IgM and IgG responses in COVID-19 patients, Baoqing Sun,Ying Feng,Xiaoneng Mo,Peiyan Zheng,Qian Wang,Pingchao Li, dostupné na https://www.tandfonline.com/doi/full/10.1080/22221751.2020.1762515
- Štandardný postup pre mikrobiologickú diagnostiku pri suspektnej infekcii vírusom SARSCoV2 pre laboratóriá klinickej mikrobiológie. MUDr. Monika Czirfuszová, PhD. a kol
- Lauren M. Kucirka, MD, PhD, Stephen A. Lauer, PhD, Oliver Laeyendecker, PhD, MBA, Denali Boon, PhD, and Justin Lessler, PhD,. Variation in False-Negative Rate of Reverse Transcriptase Polymerase Chain Reaction–Based SARS-CoV-2 Tests by Time Since Exposure, Ann Intern Med. 2020 May 13 : M20-1495. Dostupné na:
Skratky:
- Anti-SARS-CoV-2 – vyšetrenie protilátok proti vírusu spôsobujúcemu ochorenie COVID-19.
- RT PCR RNA – vyšetrenie prítomnosti nukleovej kyseliny vírusu spôsobujúceho ochorenie COVID-19 metódou real-time polymerase chain reaction.
- ELISA – enzyme-linked immunosorbent assay
- WHO – World Health Organisation
- CDC – Centers for Disease Control and Prevention
- IFCC - International Federation for Clinical Chemistry
- EUCDC – European Center for Disease Control and Prevention
- SZÚ ČR – Státní zdravotní ústav České republiky
- DIC – diseminovaná intravaskulárna koagulácia
- HDC – horné dýchacie cesty
- DDC – dolné dýchacie cesty